Tìm hiểu một số phương pháp xác định protein và các enzim trong sản phẩm nông nghiệp
Khoảng
95%
cơ thể và các bộ phận của sinh vật được
xây dựng từ carbon, hydro, oxy và nitơ và 5% còn lại chứa các yếu tố khác, bao
gồm cả những chất cần
thiết và không cần thiết. Cấu trúc của phân tích thực phẩm hóa học theo phân loại
cổ điển của các thành phần hóa học dựa trên các nhóm dinh dưỡng của hợp chất
(Hình 8). Các thành phần với nồng độ cao nhất trong các sinh vật sống là nước; (khoảng 70 đến 90% tổng khối
lượng). Hàm lượng nước của các mô giảm theo độ
tuổi. Chất khô có thể được phân loại
thành các nhóm vô cơ và hữu cơ; trong trường hợp một sản phẩm nông nghiệp một
phần quan trọng của chất tro
bắt nguồn từ nhiễm bẩn vô cơ. Phân tích xác định giá trị dinh dưỡng của thức ăn
và thực phẩm là việc xác định hàm lượng chất khô bằng phương pháp bay hơi (lượng
nước được tính từ nó); hàm lượng nitơ bằng các phương pháp tiêu hóa hoặc đốt và
protein được tính từ giá trị này; hàm lượng chất béo bằng phương pháp khai thác
và hàm lượng chất xơ bằng phương pháp tiêu hóa. Phần còn lại là carbohydrate,
axit hữu cơ, bột màu, chất chống oxy hóa và các hợp chất khác. Những yêu cầu của
hiện nay trên phân tích thực phẩm cho thấy sự quan tâm hơn về các thành phần và
định giá đầy đủ về chất lượng dinh dưỡng đòi hỏi kiến thức về vai trò, số liệu
và các nguyên tắc của phương pháp phân tích của chúng.
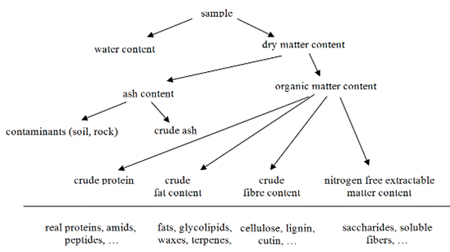
Hình 8: Thành phần của một mẫu thức ăn hoặc thức ăn chăn
nuôi
Các
hợp chất chứa nitơ
Các hàm lượng nitơ có
thể có mặt trong các dạng hữu cơ và vô cơ. Tỷ lệ các dạng hữu cơ và vô cơ là phụ
thuộc vào sản phẩm, ví dụ hơn 95% nitơ ở dạng hữu cơ trong hạt ngũ cốc, nhưng
nó có thể làm giảm trên 50% đối với rau. Vai trò của các hình thức hữu cơ cao
hơn nhiều về dinh dưỡng và sự hiện diện của các hình thức vô cơ với số lượng lớn
có thể gây hại (ví dụ nitrat).
Các axit amin, các hợp
chất nitơ hữu cơ nhỏ nhất trong các sản phẩm nông nghiệp hình thành chuỗi axit
amin và protein. Các thuộc tính (chức năng, giá trị dinh dưỡng) của các protein
được xác định bởi các thành phần acid amin và cấu trúc của polypeptide. Căn cứ
vào hình thức của chúng,
protein hình cầu (như albumin và protamines) và các protein dạng sợi (ví dụ
myosin, collagen) có thể được xác định. Căn cứ vào chức năng sinh học của chúng, gồm có protein kết cấu, lưu trữ, vận
chuyển, phòng thủ, co bóp và protein điều hòa có thể được liệt kê. protein đơn
giản có chứa các axit amin chỉ trong khi những thành phần liên hợp cũng chứa các tiểu đơn vị khác; ví
dụ. chromoproteins chứa Fe-ion (ví dụ hemoglobin), metalloproteins chứa các ion
kim loại khác (enzyme khác nhau) và lipoprotein chứa nhóm lipid (cholesterol).
Phân tích các protein
đơn giản có thể được phân loại theo độ hòa tan. Các albumin là phần dễ hòa tan nhất; chúng có thể hòa tan trong dung dịch
nước, nước muối, axit và kiềm cất, có mặt trong hầu hết các sản phẩm có nguồn gốc
thực vật và động vật (máu, hạt cây, trứng). Các globulin không tan trong nước
nhưng mặn, chua và các giải pháp alcaline họ có thể hoà tan (huyết thanh và mô,
globulin). Các prolamines không tan trong nước và nước muối và dung dịch cồn nước
60-90%, nhưng không hòa tan trong nước tập trung hoặc rượu. Chúng là những điển hình cho loại
hạt ngũ cốc. Các glutelins kháng hầu hết các dung môi; chỉ các dung dịch kiềm và axit loãng có thể tan chúng. Chúng được tìm thấy trong thực
vật, đặc biệt là trong các hạt ngũ cốc như protein lưu trữ. Các scleroproteins
đề kháng với các dung môi; chúng
có mặt trong số lượng nhỏ như protein cấu trúc và có thể được destructed bởi
cách enzym.
Việc xác định hàm lượng
protein có thể được trực tiếp với các phép đo trực tiếp của các protein trong
ma trận mẫu hoặc gián tiếp, khi hàm lượng nitơ được xác định và nó được sử dụng
trong các công thức để tính toán. Các phương pháp trực tiếp là chuẩn độ và quang
phổ. Các cơ sở của phương pháp chuẩn độ formol là nhóm amin trong dung dịch
protein có chứa trung hòa phản ứng với formaldehyde. Phản ứng này có thể được
điều chỉnh bằng natri hydroxit. Các phương pháp quang phổ thực tế sử dụng được
là tia cực tím và quang phổ của ánh
sáng nhìn thấy được. Các
phản ứng biuret trong môi trường kiềm không
liên kết ion đồng với bốn nguyên tử nitơ tạo phức màu
tím có thể được xác định ở vùng
bước sóng 540-560 nm được sử
dụng rộng rãi nhất (phương
pháp Lowry).
Các phương pháp gián
tiếp dựa trên hàm lượng nitơ của mẫu. Mặc dù các protein có chứa hàm lượng nitơ
16% trên trung bình, các loại khác nhau của các protein có hàm lượng nitơ khác
nhau, ví dụ, hàm lượng nitơ của sữa và sản phẩm sữa là 15,67% (do đó hàm lượng
nitơ cần được nhân 6.38), giá trị này cho ngô, đậu, đậu và thịt là 16.00 (hệ số:
6,25), cho hạt lúa mì và bột mì 17,15 và 17,54 (hệ số: 5,83 và 5,70), tương ứng,
và 18,31 (hệ số: 5.46) cho hạt, do đó các kiến thức về tỷ lệ nitơ đúng là điều
cần thiết cho kết quả đầy đủ. Mặt khác, tính chính xác của kết quả phụ thuộc
vào phương pháp áp dụng để xác định hàm lượng nitơ. Các phương pháp Dumas đo tổng
hàm lượng nitơ của mẫu bất kể đến hình thức của nó. Các phương pháp Kjeldahl
xác định hàm lượng nitơ protein, peptide, acid amin, amit và amoniac, chỉ có dạng
vô cơ bị oxy hóa được loại trừ. Các phân tích axit amin (AA-N) xác định số lượng
các axit amin tự do và bị chặn và phương pháp Barnstein đo lượng peptide và
polypeptide chỉ (Hình 9). Khi các giá trị tính toán được chứa dạng nitơ khác
nhau với protein, tên phân tích tham số này là hàm lượng protein thô.
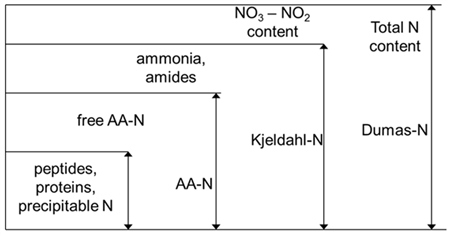
Hình 9: So sánh các phương pháp để xác định hàm lượng
nitơ
Các phương pháp Dumas
hoặc đốt xác định lượng phân tử nitơ. Đối với điều này, các nitơ có chứa hợp chất
của mẫu được đốt ở nhiệt độ cao (850-1.050 ° C) trong sự hiện diện của oxy và bạch
kim chất xúc tác và các hình thức oxit nitơ. Bước tiếp theo là giảm các oxit
nitơ tiểu khí trên đồng hoặc vonfram. sản phẩm khí này có phải được làm sạch từ
khí liên quan bằng chất hấp thụ và đo bằng cách đo khối lượng hoặc các tế bào dẫn
nhiệt. Ưu điểm của phương pháp Dumas là sự đơn giản, nhanh hơn nhiều so với
phương pháp Kjeldahl và chỉ sử dụng một số lượng nhỏ và khối lượng hóa chất,
nhưng nó đòi hỏi vốn đầu tư cao và lượng nhỏ mẫu, do đó bất cập xảy ra đối với
hàm lượng nitơ nhỏ.
Các phương pháp
Kjeldahl là phương pháp phổ biến nhất để đo hàm lượng protein thô. Đầu tiên,
các chất hữu cơ được tiêu hóa bằng cách đun
nóng với axit sulfuric, tạo ra amoni hydrogen sulfate. Bước
tiếp theo là phiên bản của nitơ; thêm một dư thừa của (NaOH) chuyển đổi nó
thành amoniac. Các giải pháp được đun sôi và amoniac khí phát hành được ngưng tụ
trong một acid nhận (acid sulfuric hoặc acid boric), trong đó hàm lượng nitơ được
xác định bằng cách chuẩn độ (NaOH hoặc axit sunfuric). Phương pháp này được quốc
tế công nhận, tiêu chuẩn hóa và được chấp thuận, đáng tin cậy, nhưng tiêu thụ
tương đối thời gian và hóa chất nguy hiểm được yêu cầu.
Phương pháp xác định
hàm lượng protein thực là phương pháp Barnstein. Đầu tiên, hàm lượng nitơ phi
protein (ammonia, amids, vv) được tách ra bởi sự kết tủa của protein thực sử dụng
đồng sunfat hoặc natri hydroxit. kết tủa này có phải được làm sạch từ các hình
thức N phi protein hòa tan bằng cách lọc và rửa trôi bởi nước nhiều lần. Kết quả
là, lượng chỉ chứa hàm lượng nitơ của các protein và peptide và các phương pháp
Kjeldahl hay Dumas có thể được áp dụng cho xác định hàm lượng nitơ của nó. Ưu
điểm của phương pháp này là việc áp dụng phương pháp này sẽ dẫn đến những phát
hiện chính xác nhất về hàm lượng protein, nhưng nhược điểm là tương tự như
phương pháp Kjeldahl.
Hàm lượng protein
tiêu hóa có thể được xác định bởi trong ống nghiệm thủy phân bằng pepsin,
pepsin-trypsin, pancreatin hoặc xử lý enzyme kết hợp. Sau khi xử lý sơ bộ, các mẫu được xử lý với
enzyme hay men ủ ở nhiệt độ quy định cho thời gian cần thiết. Định lượng
protein khả năng hòa tan có thể được thực hiện bằng phương pháp Kjeldahl hay
phân tích axit amin.
Có một số phương pháp
khác để xác định hàm lượng protein. Bên cạnh phương pháp quang phổ UV và quang phổ cộng hưởng từ hạt nhân được sử
dụng rộng rãi. Các phương pháp khác, chẳng hạn như đo chiết quang, phân cực, phương
pháp đo độ đục và phương pháp huỳnh quang kế cũng được sử dụng cho các mục đích
đặc biệt, nhưng tầm quan trọng thực tế của
chúng là rất nhỏ.
Việc đánh giá thành
phần protein của mẫu cũng rất quan trọng để đánh giá giá trị dinh dưỡng. Việc
xác định được dựa trên việc tách các tiểu đơn vị lớn hoặc nhỏ của protein hoặc
phân tích các thành phần acid amin. phương pháp đơn giản tương đối là kết tủa đẳng
điện dựa trên thực tế rằng các protein khác nhau có điểm đẳng điện khác nhau.
Việc điều chỉnh pH đến giá trị cụ thể sẽ xác định những protein phân kết tủa và
những gì còn lại trong dung dịch. Các phương pháp khác đòi hỏi cụ phân tích đầu
tư cao và chi phí hoạt động và phân tích chuyên nghiệp.
Các phương pháp hấp
phụ (trao đổi ion sắc ký, sắc ký ái lực) là cột
và phương pháp sắc ký lỏng cao áp,
khi mẫu đã chuẩn bị được chuyển qua một giai đoạn vật liệu hấp thụ rắn có chọn
lọc và ái lực hấp phụ-giải hấp của protein sẽ xác định các ràng buộc của chúng. Các điện sử dụng sự khác
biệt về kích cỡ và chuyển động của các protein trong một điện trường với pH hoặc
một gradient pH (ví dụ đẳng điện tập trung). sự khác biệt kích thước cũng có thể
là cơ sở tách ra; lọc máu, siêu lọc và sắc ký loại trừ kích thước cũng rất
thích hợp cho việc tách các protein với các kích cỡ khác nhau. Các phân tích
axit amin là xác định các axit amin duy nhất trong mẫu. Các axit amin của
protein phải được phân cách bằng thủy phân sau đó chúng có thể được đánh giá bằng
phương pháp sắc ký trao đổi ion hoặc sắc ký lỏng hiệu năng cao. Một số axit
amin có thể được phân tích bằng phương pháp trắc quang (ví dụ methionine,
cystine, tryptophan).